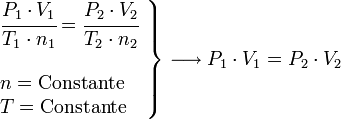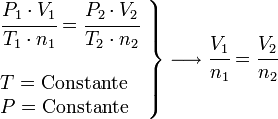IED FRANCISCO DE PAULA SANTANDER
AREA DE CIENCIAS DOCENTE ARMANDO HERRERA
EJERCICIOS DE APLICACION DE CONCENTRACION DE SOLUCIONES
CONCEPTO DE MOL
1 Rellena el espacio con alguna de estas palabras: más, menos, igual
a) 1 mol de N2 tiene _______________número de moléculas que 1 mol de H2O
b) 1 mol de Cl2 tiene _______________número de átomos que 1 mol de Fe
c) 1 mol de Hg tiene _______________número de moléculas que 1 mol de SiO2
2 ¿Cuál de las afirmaciones es correcta si nos encontramos en condiciones normales de presión y temperatura?
a) 1 mol de N2(g) tiene el mismo volumen que 1 mol de Hg(s)
b) 1 mol de Cl2(g) tiene el mismo volumen que 1 mol de H2O(l)
c) 1 mol de N2 (g) tiene el mismo volumen que 1 mol de Cl2(g)
d) 1 mol de Hg(s) tiene el mismo volumen que 1 mol de H2O (l)
e) Ninguna de las afirmaciones es correcta
3 ¿Cuál de las respuestas es correcta?
a) Si tenemos idénticas cantidades de un sólido y de un líquido, ambos ocuparán el mismo volumen en las mismas condiciones de presión y temperatura.
b) Si tenemos idénticas cantidades de dos sólidos, ambos ocuparán el mismo volumen en las mismas condiciones de presión y temperatura.
c) Si tenemos idénticas cantidades de un sólido y de un gas, ambos ocuparán el mismo volumen en las mismas condiciones de presión y temperatura
d) Ninguna de las afirmaciones indicadas es correcta.
Respuestas
1 a) igual 1b) más 1c) igual
2 c (sólo los volúmenes de gas cumplen con la relación 1mol de gas equivale a 22,4 litros, en condiciones normales de presión y temperatura
3 d, el mismo fundamento de la pregunta anterior
Ejercicios:
1 ¿Cuántos moles son 110 g de ácido clorhídrico HCl? Resp: 3,02 moles
2 ¿Cuántos moles son 140 g de nitrógeno N2? Resp: 5 moles
3 Calcula la masa que hay en 1,5 moles de anhídrido carbónico CO2. Resp: 66 g
4 ¿Qué número de moléculas contienen dos litros de agua? Resp: 6,69x1025 moléculas
5 Calcula la masa en gramos de 6,022x 1023 moléculas de anhídrido sulfuroso SO2. Resp: 64 g
6 ¿Cuál es la masa molar del metano CH4? ¿Qué número de moléculas habrá en 2 moles de metano? ¿Qué masa de hidrógeno habrá? Resp: 16 g/mol - 1,20 x1024 moléculas – 8 gramos de hidrógeno
7 ¿Cuántos moles de moléculas de agua hay en un vaso que contiene 180 g de agua? Resp: 10 moles de agua
8 Disponemos de 0,2 moles de hidrógeno gaseoso, 0,2 moles de anhídrido carbónico (CO2) y 0,2 moles de agua ¿Que masa es mayor? Resp: la masa del CO2
9 Determine la masa de un mol óxido Calcio CaO. Resp: 56 g.
10 Si en un recipiente hay 142 g de gas cloro, Cl2, ¿Cuántos moles de gas hay? ¿Cuántas moléculas de Cl2 hay? ¿Qué volumen ocupa esta masa de gas? Resp: 2 moles – 12,04x1023 moléculas – 44,8L
11 En un mol de moléculas de óxido de azufre (IV) SO2 ¿Cuantos moles de átomos de azufre hay? ¿Cuántos moles de átomos de oxígeno? Resp: 1mol y 2 moles
12 Si un recipiente lleno de gas nitrógeno tiene una masa de 56 g. ¿Cuántos moles contiene? Resp: 2 moles
13 ¿Cuántas moléculas hay en un mol de dióxido de carbono CO2? ¿Cuál es la masa de un mol de dióxido de carbono expresada en gramos? ¿Qué masa de oxígeno hay en un mol de CO2? Resp: 6,02 x1023 moléculas - 44 g - 32g
14 La masa de una mina de lápiz es 0,1035 g. Tras escribir en una página, su masa se reduce a 0,1026 g. ¿Cuánto grafito y cuantos átomos de carbono quedan en el papel? Resp: Han quedado 4,517x1019 átomos.
15 ¿Cuál es la masa de un átomo de Sodio? Resp:: 3,82x1023 g.
CONCENTRACIÓN MOLAR
1 ¿Qué M tiene una solución de ácido nítrico (HNO3), si 400 mL de la solución contienen 150 g del ácido? Resp: 6M (5,95M)
2 ¿Cuántos g de hidróxido de bario (Ba(OH)2) se necesitan para preparar 650 mL de una solución 0.2 M? Resp (22,27 g)
3 Si se desea obtener una solución 0.3M de hidróxido de potasio (KOH) disolviendo 60 g de hidróxido, ¿Qué volumen de solución se obtendrá? Resp: 3,57L
4 ¿Cuántos g de soluto se necesitan para preparar un litro de una solución 0.5 M de H2SO4? Resp: 49 g
5 ¿Cuál es la molaridad de una solución que contiene 78 g de KOH con agua en 100 mL de solución? Resp: 13,9M
6 Si se tiene una solución 3 M de HCl en agua, ¿Qué cantidad de soluto contienen 250 mL de solución? Resp: 0,75 moles o 27,4 gramos de HCl.
7 ¿Cómo prepararías 500mL de una solución 2,5M de KMnO4? Resp Pesaría 197,5 g de KMnO4, los disolvería en suficiente agua y luego completaría 500 mL de solución.
8 Se prepararon 380 mL de una solución en la que se disolvieron 0.85 moles de KOH. ¿Cuál es la Molaridad de dicha solución? Resp: 2,23 molar
9 ¿Cuál es la concentración molar de una solución que contiene 16 g de CH3OH en 200 mL de solución? Resp: 2,5M
10 ¿Cuántos moles se necesitan para preparar 1.25 L de solución 0.10 molar de NaI? Resp: 0,125 moles
CONCENTRACIÓN MOLAL
1 Calcule la molalidad de 13,0 gr de benceno C6H6 disuelto de en 17 gr de tetracloruro de carbono CCl4 Resp: 9,79m
2 ¿Cuántos g de CaCl2 se deben agregar a 300 g de agua para preparar una solución de concentración 2,26 molal? Resp:75,19 g de CaCl2
3 Calcular la molalidad de una solución formada por 54 g de glucosa C6H12O6 en 600 mL de de agua, teniendo en cuenta que la densidad del agua es 1 g/mL y el peso molecular de la glucosa es 180 g/mol. Resp: 0,5m
4 Se disuelven 100 gramos de Al2(SO4)3 en 200 gramos de agua, obteniéndose 250 mL de solución. Calcular la molalidad de la solución resultante Resp: 1,46m
5 ¿Qué cantidad de alcohol se deberá agregar a 80 gramos de I2 para preparar una solución desinfectante 3,5 m de este elemento? Resp: 90 gramos de alcohol.
6 ¿Cuántos gramos de NaCl están disueltos en una solución de 2 molal de esta sal que se prepararon disolviendo NaCl en 44,15 mL de agua? (recuerde que la densidad del agua es 1g/mL) Resp: 5,17 g de NaCl
7 La solubilidad del clorato de potasio, KClO3 a 30°C es de 10 g/100g H2O ¿Qué molalidad presenta una solución saturada de KClO3? Resp: 0,82 molal
DILUCIÓN DE SOLUCIONES
1 ¿Qué volumen de agua en mL se requiere para diluir 11 mL de una solución de ácido nítrico 0,45M a una concentración de 0,12M? Resp: 30mL.
2 150 mL de solución 4 molar de nitrato de plata, disuelta en agua, se prepararon a partir de una solución concentrada 10 molar, del mismo compuesto. ¿Qué volumen de la solución concentrada se tomó para prepararla? Resp:
3 Qué concentración debe tener una solución de HF para que con 200 mL de esta misma se preparen 60 mL del mismo ácido en una concentración 0,5M? Resp:
4 ¿Cómo prepararía 15 mL de ácido sulfúrico H2SO4 0,2M a partir del mismo ácido en concentración 6M? Resp: Tomaría 3 mL de la solución concentrada y le agregaría agua hasta completar 15 mL de solución
5 Se tienen 4 L de solución de HNO3 12 M; sobre ella se agregan 560 mL de agua. ¿Qué concentración tiene la solución resultante? ¿Cuántas veces disminuyó la concentración? Resp: 10, 53M – 1.14 veces
6 Se debe llenar una botella de 12 L con solución de HCl 6 M. ¿Qué volumen de solución 18 M de ácido se deben poner en la botella antes de llenarla con agua? Resp: 4 L
APLICACIÓN
1 Un cierto tipo de ácido nítrico HNO3 cuya densidad es 1,405 g/mL, contiene una concentración 68,1% p/p de ácido en agua. ¿Cuál es su concentración molar? Resp: 15,19 M.
2 Una solución de HCl (ácido clorhídrico) contiene 36% en masa de HCl
a) Calcule la molalidad del HCl en la solución.
b) ¿Qué información adicional se necesitaría para calcular la molaridad de la solución?
Resp: a) 15 m b) Se debe conocer el volumen de la solución. Si se conoce la densidad de la solución se puede conocer el volumen, a partir de la masa de la solución.
3 El ácido ascórbico, vitamina C, es una vitamina soluble en agua. Una solución que contiene 80,5 gr de ácido ascórbico C6H8O6, disuelto en 210 gr de agua, tiene una densidad de 1,22 g/mL a 55 ºC. Calcule:
a) molalidad
b) molaridad
Resp: a) 2,18m b) 1,92 M
4 ¿Qué % en masa tiene una solución 8m de NaCl disuelto en agua? Resp: 46.8%m/m
5 ¿Qué volumen de solución acuosa de carbonato de sodio (Na2CO3) 0,5m (δ=1,09g/mL) deberá utilizarse en una reacción en la que se requieren 12,6 g de sal? Resp: 229,67 mL
6 Calcular las masas y los moles de soluto presentes en las siguientes soluciones acuosas:
a) 6,5 kg de solución 0,5 M de ZnCl2 (dens.= 1,20 g/mL).
b) 3,2 kg de solución 0,2 m de Mg(OH)2.
c) 200 mL de solución 5 m de (NH4)2SO4 (δ=1,14 g/mL).
Resp: a) 369,56 g, 2,71 moles. b) 36,89 g, 0,63 moles. c) 90,65 g, 0,69 moles.
7 Calcular la molaridad y la molalidad de las siguientes soluciones acuosas:
a) HCl comercial al 36% m/m, dens.= 1,18 g/mL
b) NaOH comercial al 50,5% m/m, dens.= 1,53 g/mL
c) H2SO4 comercial al 98% m/m, dens.= 1,84 g/mL
Resp: a) 11,64 M - 15,41 m b) 19,32 M - 25,51 m c) 18,40 M, 500,0 m
Se mezclan 5,00 g de cloruro de hidrógeno (HCI) con 35,00 g de agua, formándose una disolución cuya densidad a 20 ºC es de 1,060 g/cm3. Calcúlese:
a) La molaridad
b) La molalidad.
Resp: a) 3,63M b) 3,92m

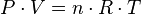
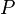 =
= 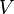 =
= 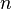 =
= 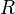 =
= 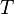 =
= 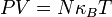
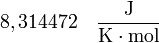
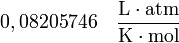
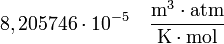
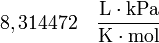
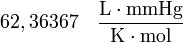
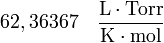
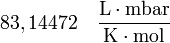
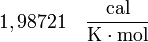
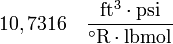
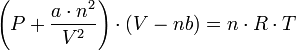
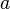 y
y 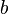 son constantes determinadas por la naturaleza del gas con el fin de que haya la mayor congruencia posible entre la ecuación de los gases reales y el comportamiento observado experimentalmente.
son constantes determinadas por la naturaleza del gas con el fin de que haya la mayor congruencia posible entre la ecuación de los gases reales y el comportamiento observado experimentalmente.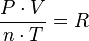
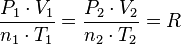
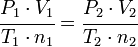
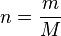
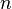 , obtenemos:
, obtenemos: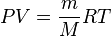
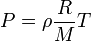
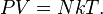
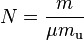
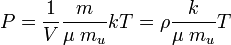
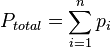 o igual
o igual 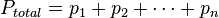
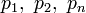 representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen
representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen