CARACTERISTICAS DE LOS GASES
CARACTERISTICAS DE LOS GASES
Comprensión
Tomando como referencia el tamaño de las partículas de un gas, existe una gran distancia de espacio vació entre ellas, lo que hace posible su comprensión o compresibilidad, es decir, la reducción o disminución de los espacios vacíos entre sus moléculas; lo cual se logra aumentando la presión y/o disminuyendo la temperatura.
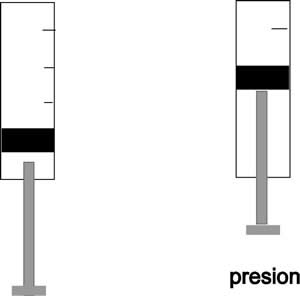
Expansión
Cuando se calienta una muestra de gas, aumenta la velocidad promedio de sus partículas, las cuales se mueven en un espacio mayor, dando como resultado que todo el gas aumenta su volumen se han expandido.
Experimentos de compresión y expansión
Video del experimento de compresión y expansión de gases
Ejercen presión sobre el recipiente que los contienen
Al estar en continuo movimiento, las partículas de un gas chocan contra las paredes del recipiente que los contiene, ejerciendo presión sobre ellas.
Difusión
Cuando dos gases entran en contacto, se mezclan hasta quedar uniformemente repartidas las partículas de uno en otro, esto es posible por el gran espacio existente entre sus partículas y por el continuo movimiento de estas.
VARIABLES FUNDAMENTALES
UNIDADES FÍSICAS
Presión: se define como la fuerza aplicada por unidad de área
P=F/A
Donde: P= presión
F= fuerza
A= área.
Las unidades de medida de la presión se representan por el cociente de las unidades de fuerza entre las de superficie: g/cm², kg/cm², lb/in², atmósferas, torricelli, etc.
Volumen: se define como el espacio ocupado por un cuerpo. Las unidades de medida del volumen son: centímetros cúbicos (cm³) decímetros cúbicos (dm³), metros cúbicos (m³), litros (L) mililitros (mL), kilolitros (kL), etc.
Equivalencias
1L = 1000 mL
1 dm³ = 100 cm³
1 L = 1 dm³
1mL = 1 cm³
1kL = 1000 L
1 m³ = 1000 L
Temperatura:
¿Qué es la temperatura? La temperatura es una propiedad de los sistemas que nos indica cuando dos sistemas han alcanazado el equilibrio térmico. Para el modelo de gases ideales, la temperaura se define como la medida de la energía cinética promedio que tienen las partículas de un sistema.
Consideremos dos sistemas A y B, en los cuales la temperatura A es mayor que la temperatura B. Los sistemas son cerrados: no puede salir o entrar materia de ellos, aunque la energía si lo puede hacer. Los dos sistemas se ponen en contacto y se observa que se transfiere energía del sistema A (de mayor temperatura) al sistema B (de menor temperatura) hasta que estas se igualan. En dicho punto se dice que los dos sistemas se encuentran en equilibrio térmico.
Unidades químicas
Mol
Unidad de medida (SI) de la cantidad de sustancia (n)
Un mol se define como la unidad de cantidad de sustancia que contiene tantas entidades elementales como átomos hay en 0.012 kg de carbono 12 (14a. Conferencia General de Pesas y Medidas - 1971, resolución 3).
Pero ¿Cuántos átomos hay en 12 g de C 12?
6.022x1023 átomos
A este número se le conoce como Número de Avogadro en honor al Químico Italiano Amadeo Avogadro.
0 comentarios