LEYES DE LOS GASES
Ley de Dalton(Presiones parciales)
Fue formulada en el año 1803 por el físico, químico y matemático británico John Dalton. Establece que lapresión de una mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones parciales que ejercería cada uno de ellos si solo uno ocupase todo el volumende la mezcla, sin cambiar la temperatura. La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla de gases.
Se puede hacer una definición más formal de la teoría mediante la aplicación de matemáticas, la presión de una mezcla de gases puede expresarse como una suma de presiones mediante:
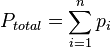 o igual
o igual 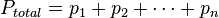
Donde 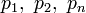 representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
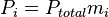
Donde mi corresponde a la fracción molar de uno de los componentes de los gases
Ley de Boyle-Mariotte
También llamado proceso isotérmico. Afirma que, a temperatura y cantidad de gas constante, el volumen de un gas es inversamente proporcional a su presión:
Proceso isotermico ( Boyle)
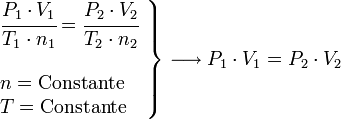
Leyes de Charles y Gay-Lussac
En 1802, Louis Gay Lussac publica los resultados de sus experimentos, basados en los que Jacques Charles hizo en el 1787. Se considera así al proceso isobárico para la Ley de Charles, y al isocoro (o isostérico) para la ley de Gay Lussac.
Proceso isobaro ( Charles)
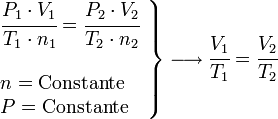
Proceso isocoro ( Gay Lussac)
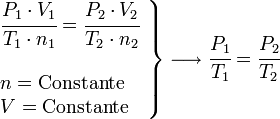
Ley de Avogadro
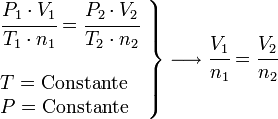
Esta ecuación es válida incluso para gases ideales distintos.